국내 임상 3상 중인 '에페글레나타이드' 후속 비만신약 후보물질2030년 상용화 목표
-
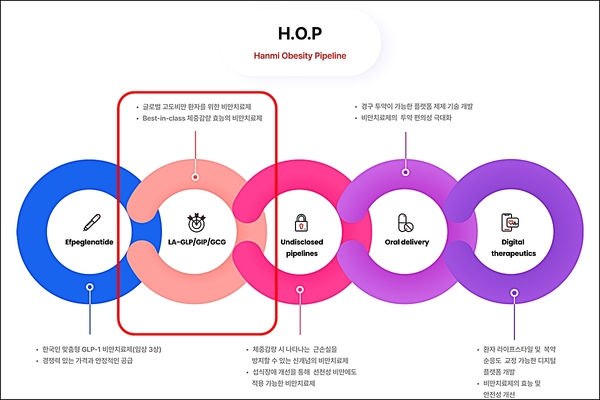
- ▲ H.O.P 프로젝트.ⓒ한미약품
한미약품이 지난달 29일(현지시각) 미국 식품의약국(FDA)에 차세대 비만 치료 삼중작용제 ‘HM15275(LA-GLP/GIP/GCG)’ 임상 1상 시험계획(IND)을 신청했다고 1일 밝혔다.임상 1상 시험계획의 목표는 건강한 성인 및 비만 환자를 대상으로 HM15275의 안전성과 내약성, 약동학, 약력학 특성 등을 평가하는 것이다.한미약품은 2030년 HM15275를 상용화한다는 목표를 세웠다. 지난 2월29일 한국 식품의약품안전처에도 IND를 제출한 바 있다.HM15275는 현재 국내에서 임상 3상 시험 중인 ‘에페글레나타이드’를 이을 차세대 비만 신약 후보물질이다. 글루카곤 유사 펩타이드(GLP-1)와 위 억제 펩타이드(GIP), 글루카곤(GCG) 등 각각의 수용체 작용을 최적화해 근 손실을 최소화하면서도 25% 이상 체중 감량 효과가 기대된다.한미약품은 오는 6월 미국에서 열리는 2024 미국 당뇨병학회(ADA)에서 HM15275에 대한 연구결과를 발표할 예정이다.ADA에서 한미약품은 비만 모델에서 체중감량 효능에 대한 HM15275의 계열 내 최고신약(Best-in-class) 잠재력 및 그 작용 기전을 규명한 결과를 공개할 계획이다. 비만이 주요 원인이라고 알려진 다양한 심혈관계 질환 모델에서 HM15275의 차별화된 치료 효능도 소개한다.최인영 한미약품 R&D센터장은 “오랜 기간 대사성 질환 분야에서 쌓아온 R&D 역량을 토대로 세계적 사회 문제로 대두되고 있는 비만 영역에서 새로운 혁신 가능성을 지속적으로 창출해 나가고 있다”며 “제약강국을 향한 열정과 집념으로 가득 찬 한미의 R&D 혁신은 결코 멈추지 않을 것”이라고 말했다.







