의료기기 사전검토 대상 확대 등 민생불편·부담 개선 혁신제품 신속심사 지원체계 ‘GIFT’ 신설
-
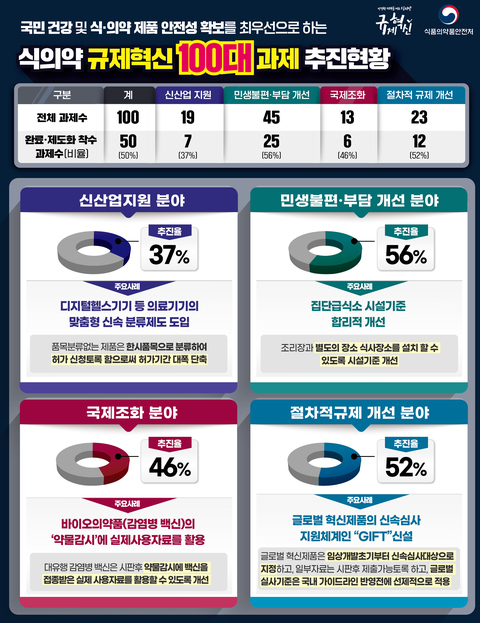
- ▲ ⓒ식품의약품안전처
식품의약품안전처는 지난 8월 발표한 ‘식의약 규제혁신 100대 과제’가 50% 추진율을 보였다고 29일 밝혔다.식약처는 혁신제품의 신속한 시장 진입과 글로벌 경쟁력을 강화를 지원하는 동시에 국민 안전·건강을 최우선으로 두고 시대·환경 변화에 맞지 않는 규제를 폐지·완화하기 위한 조치를 시행 중이다.분야별로 ▲신산업 지원 37% ▲민생불편·부담 개선 56% ▲국제조화 46% ▲절차적 규제 해소 52%로 추진되고 있다.이 중 개선 추진율이 가장 높은 민생불편·부담 개선분야에서 의료기기 사전검토 대상을 임상시험용 의료기기와 혁신 의료기기까지 확대했다.또 내년 1월 1일부터 시행되는 소비기한 표시제에 계도기간 1년을 부여해 업계 부담을 완화할 예정이다.절차적 규제 해소 분야에서는 글로벌 혁신제품 신속심사 지원체계인 'GIFT'를 신설해 임상 개발 초기 단계부터 지원했다.코로나19 치료제 임상 지표로 ‘증상 개선 효과’를 추가해 임상을 용이하게 했다. 기존에는 입원, 사망 등 중증 악화 예방효과를 입증하는 것이 필수적으로 요구됐었다.식약처는 “규제혁신의 성과를 현장에서 직접 체감하는 규제혁신 100대 과제와 관련 50%의 추진율을 보이고 있다”며 “앞으로도 규제혁신과제를 지속적으로 발굴해 신기술을 적용한 혁신제품이 신속하게 시장으로 진입할 수 있는 발판을 만들 것”이라고 밝혔다.







