cGAMP 화합물분자를 면역세포에 전달하는 캐리어(CUH) 제작cGAMP 높은 안정성 유도, 세포 내 자연분해 등 장점화학공학 분야 국제학술지 '케미컬 엔지니어링 저널'에 게재
-

- ▲ 왼쪽부터 고려대 김용주 교수, 한국과학기술연구원 이상희 박사(이상 교신저자)와 고려대 박정연 박사과정생, 한국과학기술연구원 강미소, 임송현 연구원(이상 공동1저자).ⓒ고려대
고려대학교는 고려대-한국과학기술연구원(KU-KIST) 융합과학기술대학원 융합에너지공학과 김용주 교수 연구팀과 KIST 이상희 박사팀이 DNA 나선구조의 왓슨-크릭 상보 결합에서 착안해 자연적으로 형성되며 세포 내 분해가 가능한 '선천 면역력을 강화하는 초분자 항암 소재'를 개발했다고 15일 밝혔다.고리형 다이뉴클레오타이드(이하 CDN) 화합물 분자는 일종의 경고 신호 역할을 하는 분자다. 바이러스나 불안정한 암 염색체의 DNA가 세포질로 떨어져나오면 cGAS 아미노산 단백질이 결합하면서 경고 신호 역할을 하는 cGAMP라는 화합물 분자를 만든다.세포 내 이 경고 신호가 나타나면 바이러스 침입을 해결하려고 STING이라는 면역반응이 일어난다. cGAMP 분자는 STING 반응 경로를 활성화해 바이러스에 감염된 세포에 면역 공격을 불러일으킨다. 그러나 생체 내 다양한 효소가 cGAMP를 분해하면서 cGAMP가 면역 세포에 온전히 도달하지 못해 치료가 어렵다는 한계가 있다.기존 연구는 폴리에틸렌 글리콜(PEG), 지질 혹은 금속 나노입자 등을 사용해 cGAMP의 안정적인 세포 내 이입을 시도했다. 하지만 기존 소재들은 생체 내 안정성이 떨어지고, cGAMP만을 위한 소재가 아니어서 생체 내 분자와 상호작용해 부작용을 유발할 수 있다는 문제가 있었다. -
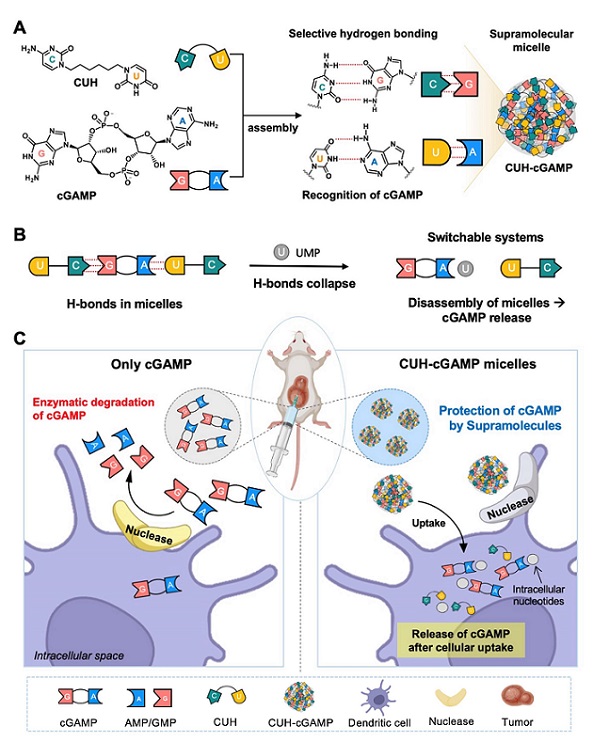
- ▲ 선천면역강화 초분자 나노 소재에 대한 모식도.ⓒ고려대
공동 연구팀은 cGAMP의 구아노신, 아데노신과 상보적인 수소결합이 가능한 사이토신, 우라실로 구성된 퍼즐과 같은 약물 전달 캐리어(CUH)를 제작했다. 개발된 CUH 소재는 cGAMP만을 위한 선택적인 약물 전달 캐리어로, cGAMP의 높은 안정성을 유도한다. 세포 내에서만 분해가 가능한 장점이 있다.이번에 개발된 CUH-cGAMP 초분자 나노 입자는 약 3주간 구형의 구조를 안정적으로 유지해 세포 내 cGAMP 전달성이 뛰어나다. 또한 세포 내로 침투한 초분자 나노 입자는 세포 내에 존재하는 다른 뉴클레오타이드와의 경쟁적인 수소결합으로 자연스럽게 분해된다.CUH-cGAMP 초분자 나노입자는 세포 내에서 선택적으로 STING 경로를 강화하면서 면역 증진의 효과를 냈다. 기존 cGAMP보다 종양 세포의 성장을 훨씬 억제하는 효능도 보였다.이번 연구 결과는 화학공학 분야 국제학술지 '케미컬 엔지니어링 저널'에 지난달 24일 게재됐다. 김용주 교수와 KIST 이상희 박사가 교신저자, 고려대 박정연 박사과정생과 KIST 강미소·임송현 연구원이 각각 공동1저자로 참여했다.이번 연구는 KIST·과학기술정보통신부·산업통상자원부·한국연구재단의 기초연구실지원사업, 중견연구자지원사업, 국제협력사업 지원을 받아 이뤄졌다. -

- ▲ ⓒ고려대







