-
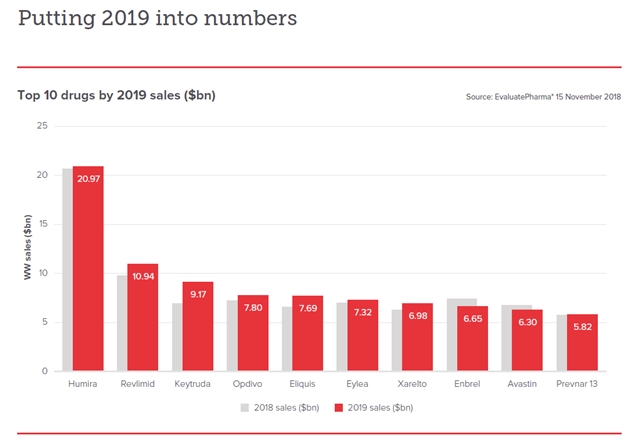
- ▲ 2019년 글로벌 매출 '톱 10' 의약품 전망 ⓒ이벨류에이트파마(EvaluatePhama)
글로벌 의약품 매출 1위인 애브비(Abbvie)사의 자가면역질환 치료제 '휴미라'가 올해 바이오시밀러와의 경쟁 심화로 매출 감소폭이 커질 전망이다.
제약산업분석업체 EP 밴티지(EP Vantage)의 2019년 제약·바이오 분야 전망 보고서에 따르면, 휴미라의 올해 글로벌 매출은 209억 7000만 달러(약 23조 5000억원)로 전망된다.
EP 밴티지는 2019년 글로벌 의약품 매출액 순위에서 휴미라가 여전히 1위를 차지할 것으로 내다봤다. 그러나 글로벌 의약품 매출 '톱10' 중 휴미라의 매출 감소 폭은 가장 클 것으로 예측했다.
휴미라의 바이오시밀러가 대거 등장했기 때문이다.
지난해 10월 유럽에서 삼성바이오에피스, 암젠, 산도스, 마일란·후지필름쿄와기린 등이 휴미라의 바이오시밀러를 출시했다. 이에 애브비는 유럽 입찰가를 최대 80%까지 인하하는 등 반격에 나선 바 있다.
올해에도 애브비의 휴미라는 바이오시밀러와의 전쟁이 치열할 것으로 예상된다.
애브비는 휴미라의 글로벌 바이오시밀러 경쟁으로 인해 직접적인 영향을 받는 매출액은 60억 달러(약 6조 7000억원) 규모일 것으로 내다봤다.
미국의 바이오시밀러 시장 확대 가능성이 높아지고 있다는 점도 오리지널 의약품 업체인 애브비를 불안하게 하는 요인이다.
미국 식품의약국(FDA)은 이번 JP모건 헬스케어 콘퍼런스에서 저렴한 바이오시밀러 시장을 촉진시키겠다는 의지를 드러냈다.
스콧 고틀립 FDA 국장은 8일(현지시간) 미국 샌프란시스코에서 열린 JP모건 헬스케어 콘퍼런스의 영상 기조 연설을 통해 "바이오시밀러 출시 촉진 등을 통해 여러 제품을 경쟁시켜 의약품 가격을 내리겠다"고 발표했다.
지난해에 이어 FDA가 약가 인하 정책을 올해도 유지하겠다는 뜻을 확고히 전한 셈이다.
더 나아가 FDA는 오리지널 의약품 업체들의 리베이트도 견제해 바이오시밀러의 미국 시장 진출에 힘을 보탤 것으로 보인다.
그간 미국 시장에 진출하는 바이오시밀러가 겪을 어려움으로는 오리지널 의약품 업체들의 리베이트 등 견고한 방어 전략이 제기돼 왔다.
미국에서는 병원이 의약품을 구매할 때 보험사로부터 일정한 리베이트를 지급 받는다. 대개 바이오의약품 등 고가의 의약품일수록 리베이트 규모도 크기 때문에 비교적 저가인 바이오시밀러는 리베이트와 관련해 불리한 편이다.
이에 대해 고틀립 국장은 "바이오시밀러가 오리지널약보다 가격이 낮지만 결국 오리지널약 처방 시 제공하는 리베이트가 있을 것"이라며 "(리베이트 규제가) FDA의 관할은 아니지만 해결할 방법을 찾아보겠다"고 언급했다.
하지만 유럽과 달리 휴미라의 미국 특허권은 오는 2023년까지 보장된다. 따라서 애브비는 2023년까지는 바이오시밀러로 인한 미국 매출 감소 영향은 없을 것이라고 내다봤다. 휴미라의 글로벌 매출액의 약 65%는 미국에서 차지하고 있다.
다만, 미국 특허권이 만료되는 시점에는 삼성바이오에피스 등이 개발한 휴미라의 바이오시밀러 제품들이 미국에 출시되면서 유럽 시장처럼 치열한 가격 경쟁으로 인한 매출 하락이 불가피할 전망이다.
국내 업체의 경우 삼성바이오에피스가 지난해 4월 휴미라의 바이오시밀러인 'SB5'(유럽명: 임랄디) 특허 관련 분쟁을 애브비와 합의하고 라이선스 계약을 체결한 바 있다. 해당 계약에 따라 삼성바이오에피스는 오는 2023년 6월부터 미국에서 SB5 판매가 가능해진다.
셀트리온은 지난해 8월 영국 의약품허가기관(MHRA)에 휴미라의 바이오시밀러 'CT-P17'의 임상 1·3상을 신청했다고 밝힌 바 있다. 오는 2020년 임상 3상 완료를 목표로 하고 있다.
업계 관계자는 "FDA가 바이오시밀러 시장 촉진 정책을 펼치겠다고 발표한 것은 반갑지만 당장 미국 시장에서 오리지널 제약사의 리베이트가 근절되는 등 가시적인 결과로 이어지긴 힘들 것"이라면서도 "중장기적인 관점에서는 미국 시장에 진출할 바이오시밀러 기업들에 청신호로 작용할 것"이라고 말했다.
글로벌 매출 1위 '휴미라', 바이오시밀러와 매출 전쟁 격화 전망
- 김새미 기자
입력 2019-01-14 14:55수정 2019-01-14 15:23
공유하기
기사 공유하기
휴미라, 올해 글로벌 매출 전망 23조원… 글로벌 의약품 중 매출 1위바이오시밀러 경쟁 영향 받을 휴미라의 매출 감소, 6조7000억 추정애브비 "특허 유지되는 2023년까지 미국 시장 매출에는 영향 없을 것"
김새미 기자







