-

- ▲ 한미약품 사옥.ⓒ한미약품
한미약품이 폐암신약 물질 '올리타정 (성분명 올무티닙)'의 부작용 논란에도 불구하고 개발을 계속해나가겠다는 입장을 밝혔다. 식품의약품안전처가 올리타정의 잠재적 위험보다 치료 기회 제공 등의 유익성이 더 크다고 판단했기 때문이다.
식약처는 4일 중앙약사심의위원회를 열고 올리타정의 시판 허용을 유지하기로 결정한 뒤 "의료진이 올리타정을 복용하는 환자에게 중증피부이상반응의 부작용이 생길 수 있다는 것을 미리 알리고 복용에 대한 동의를 받아 사용해야 한다"고 조건을 달았다.
△ 의약품 허가 유지…병색 나쁜 말기 환자에게도 치료 기회 제공 위해
올리타정은 기존 치료제로는 효과가 없어 더 이상 치료방법이 없는 말기 암환자에게 사용하는 약이다.
이미 병색이 좋지 않은 환자를 대상으로 하는 약물이므로 다른 약에 비해 설사, 발진, 피부 독성 등의 부작용이 발생하거나 증상이 악화되기 쉽다.
식약처는 지난 4월 올무티닙의 첫 부작용 사례가 발생했으며 5월에 올리타정을 조건부 시판 허가했다. 올무티닙 임상시험 결과에 따르면 731명 중 3명(0.4%)에게서 피부 독성 등의 부작용이 발생했다.
이원식 의약품 안전국장은 "첫 사례 환자는 당뇨병 등 기저질환을 갖고 있어 올리타정과 피부 독성 간의 연관성이 명확하지 않다고 판단했다"며 "이어 중증피부이상반응에 대한 보고가 반복됨에 따라 인관관계를 재평가했다"고 설명했다.
식약처가 올리타정 임상시험을 면밀히 검토한 결과, 올리타정의 피부독성 부작용은 비슷한 계열의 치료제 중에서도 충분히 발생할 수 있는 이상반응이라는 결론이 나왔다. 올리타정의 이상증상 발생빈도는 다른 치료제와 비교했을 때 비슷하거나 약간 낮은 수준으로 비교적 안전한 약이라고 볼 수 있다는 게 식약처의 입장이다.
△ 한미약품, 울리타정 개발 계속할 것…방향 논의 중
한미약품은 올리타정의 안전성 논란이 불거짐에도 불구하고 관련 임상 진행을 계속하겠다는 계획이다.
지난 2일 한미약품은 긴급기자간담회를 열고 "올리타정 개발 방향에 대해 현재 다각도로 분석하고 있다"며 "스폰서 변경 등을 통해 남은 임상을 계속 진행할 것"이라고 말했다.
올리타정이 지닌 치료 효과와 부작용 발현율을 다른 치료제에 비해 비교했을 때 시장성이 아직 있다는 판단에 의거해서다. -
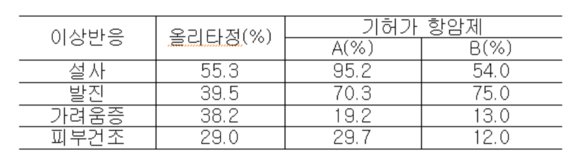
- ▲ 올리타정, 기타 항암제와 이상반응 발현율 비교 표.ⓒ식약처
특히 더 이상의 치료방법이 없는 말기 암환자에게 적용할 수 있다는 점을 개발 지속 이유로 들었다.
△ 늦장 공시에 대해 '의도한 바 아냐' 극구 부인하지만 논란 계속될 듯'올리타정'사건은 한미약품 주가가 널뛰기를 뛰면서 투자자들의 가슴을 타들어가게 했다.
4일 한미약품 주가는 47만1000원으로 베링거잉겔하임과 기술수출 계약이 파기되면서 급락한 30일 주가 50만8000원보다 7.28% 더 떨어졌다.
29일 오전 한미약품 주가 65만4000원 대비 약 28%이나 하락한 셈이다.
한미약품은 지난 30일 베링거잉겔하임과 기술수출 계약 해지 공시를 신속하게 발표하지 않아 개인 투자자 등의 피해를 양산했다는 지적을 받고 있다.
한미약품은 베링거잉겔하임의 계약해지 통보를 받은 날 바로 공시하지 않고 다음날 개장 30분 후까지 지연했다.
늦장 공시에 대해 한미약품 측은 "한국거래소 담당자의 자문을 통해 면밀히 검토 후 공시하려고 했다"고 해명했으나 이유가 충분하지 않다는 이유로 금융업계는 투자자를 기만하는 행동이라고 지적하고 있어 논란은 계속될 전망이다.△ 제약업계 "부작용 발생으로 개발 중단 사례 있지만 장기적 안목 필요"
올무티닙 사건에 대해 제약업계는 "신약 개발 중 임상 중단은 피할 수 없는 일"이라며 "신약 개발을 위한 성장통으로 장기적인 안목으로 연구가 필요하다"고 평가했다. 즉 베링거잉겔하임의 올무티닙 개발 중단으로 제약업계 신약개발이 위축되면 안된다는 게 제약업계의 입장이다.
임상 도중 신약후보물질 개발이 중단되는 사례는 빈번한 것으로 나타났다. LG생명과학, 종근당 등 많은 제약사들이 신약 개발 기술을 수출한 후 한미약품 올무티닙처럼 기술이전한 물질에 대한 판권을 돌려받은 경험이 있다.
종근당은 비만치료제 후보물질 ‘벨로라닙’의 기술을 미국 제약사 자프겐에 넘겼으나 혈전증 등 부작용 발생으로 인해 개발이 중단됐다.
신약 개발은 대표적인 '하이 리스크, 하이 리턴(High risk, high return)' 산업으로 꼽힌다. 제약 업체들은 신약 개발을 위해 평균 10년이 넘는 기간과 수천억원대의 자금을 쏟아붓지만 개발에 성공해 시판 제품으로 출시할 확률은 9.6%로 극히 낮다.
한미약품은 베링거잉겔하임과 올무티닙을 공동으로 개발해왔지만 임상 단계 중 성공 확률이 가장 낮은 임상 2상에서 실패하자 베링거잉겔하임이 더이상 개발에 참여하지 않겠다는 의사를 밝히면서 한미약품은 새로운 파트너사를 찾고 있다.
미국 식품의약국(FDA)에 따르면 임상 1상, 임상 2상, 임상 3상 성공률은 각각 63.2%, 30,7%, 58.1%로 조사됐다.
한미약품 '올무티닙' 부작용 논란 … 제약업계 "신약개발 위축되면 안돼"
- 한아름
입력 2016-10-04 15:41수정 2016-10-04 19:02
공유하기
기사 공유하기
한미약품·식약처, "올무티닙, 동등 계열 치료제보다 유해성 낮아 투여·개발에 문제 없다"
한아름







