타우 단백질 R3 반복 구역의 병인성 프라이온 특성 최초 규명파킨슨병 치료제 톨카폰의 타우 응집 해체·억제 효과 확인신경퇴행성 질환에 대한 표적치료 전략에 새 접근법 제안
-

- ▲ 연세대 약학과 김영수 교수(왼쪽)와 바이오융합공학과 윤솔지 박사과정생(제1저자).ⓒ연세대
연세대학교는 약학과·바이오융합공학과 김영수 교수 연구팀이 알츠하이머병의 주요 원인 중 하나로 알려진 병인성 타우 단백질이 R3 반복 영역에서 독성 응집체를 형성한다는 점을 밝혀내 알츠하이머병 치료제 개발에 중요한 이정표가 제시했다고 7일 밝혔다. 이번 연구 결과는 국제적인 화학 학술지 '앙게반테 케미'에 지난달 24일 실렸다.알츠하이머병은 아밀로이드 베타(Aβ)와 타우 단백질의 병리적 축적이 특징인 신경퇴행성 질환이다. 그동안 대부분의 연구는 Aβ 축적에 초점을 맞춰 왔으나, 최근 연구는 타우 단백질의 비정상적인 응집이 인지 기능 저하와 밀접한 관련이 있음을 보여준다. 타우 단백질의 병리적 역할을 규명하는 것이 알츠하이머병 치료 전략 개발에 있어 핵심적인 과제로 부상하고 있다. -
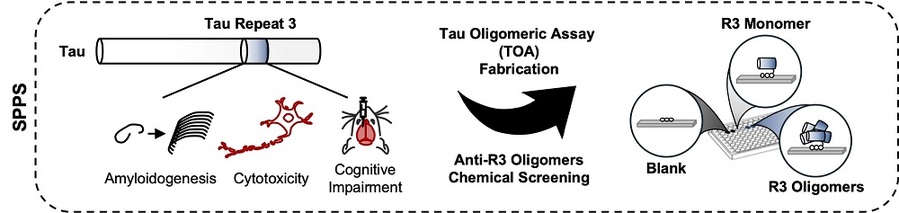
- ▲ 연구 개발 전략 및 흐름도.ⓒ연세대
연구팀은 타우 단백질의 R3 반복 영역이 자발적으로 응집해 독성 응집체를 형성하고, 이 응집체가 신경세포 손상과 인지 기능 저하를 유발한다는 사실을 밝혀냈다.또한 병을 일으키는 타우 단백질 응집체를 표적으로 하는 신약 개발을 위해 독자적인 스크리닝 플랫폼을 구축했다. 이를 통해 파킨슨병 치료제로 알려진 '톨카폰'이 타우 단백질의 R3 영역에 선택적으로 결합해 응집된 단백질을 해체하고 병리적 타우 응집을 억제하는 효과를 확인했다.이번 연구는 타우 단백질 응집의 원리를 이해하고, 새로운 표적 치료 전략을 제시해 알츠하이머병 치료제 개발에 새로운 가능성을 열었다는 점에서 중요한 성과로 평가된다.김 교수는 "타우 응집체는 알츠하이머병의 진행에서 중요한 역할을 한다"며 "이번 연구는 타우 R3 반복 영역이 병의 핵심 기전임을 확인함으로써 타우를 표적으로 하는 신약 개발에 중요한 기초자료를 제공할 것"이라고 말했다.
이번 연구는 한국연구재단의 중견연구사업과 중점연구소지원사업, 한국보건산업진흥원 치매극복연구개발사업단의 지원을 받아 진행됐다. 김 교수가 교신저자, 바이오융합공학과 윤솔지 박사과정생이 제1저자로 참여했다. -

- ▲ ⓒ연세대







