-
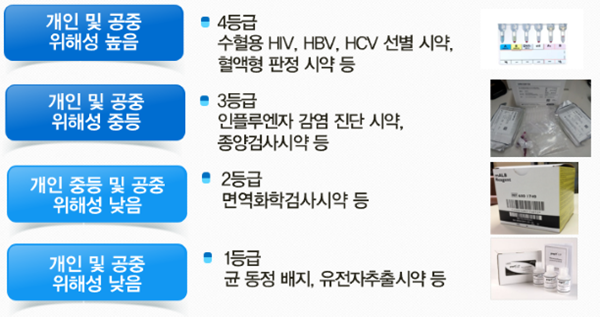
- ▲ 체외진단의료기기 등급 분류 기준 ⓒ식품의약품안전처
식품의약품안전처(이하 식약처)는 신종 코로나바이러스 감염증-19(이하 코로나19) 진단시약과 같은 체외진단 의료기기의 안전 관리를 위해 제정한 체외진단의료기기법을 1일부터 시행한다.
이번에 시행되는 체외진단의료기기법과 하위법령은 ▲진단 결과가 공중보건 등에 미치는 영향에 따른 등급 분류 ▲맞춤형 허가·인증·신고 체계로 구분 관리 ▲임상적 성능시험 기반 확대·강화 등을 골자로 한다.
체외진단 의료기기의 등급은 안전관리 수준이 높은 순서에 따라 1~4등급으로 분류한다.
1등급은 신고, 2등급은 인증, 3~4등급은 허가로 구분해 관리한다. 허가·인증은 제품 성능을 확인할 수 있도록 분석적 성능시험, 임상적 성능시험을 구체화한다. 안전성·유효성에 영향을 미치지 않는 경미한 변경사항은 사후 보고하도록 함으로써 신속한 제품 출시를 지원한다.
임상적 성능시험 기관은 의료기관, 혈액원, 의과대학과 검체수탁·분석기관 등에서 지정한다. 임상적 성능시험을 위해서는 사전에 심사위원회 승인을 받아야 한다. 임상적 성능시험 종사자는 전문교육을 매년 8시간 이상 이수해야 한다.
의료기관·유전자검사기관에 대해 차세대염기서열분석 체외진단검사 인증제를 실시하는 등 체외진단검사 인증제도 도입한다. 인증된 검사에 사용하는 체외진단 의료기기는 허가절차를 면제한다.
식약처 관계자는 "체외진단 의료기기 특성에 맞는 안전 관리체계를 마련하고 국제기준에 맞는 제도를 운영함으로써 체외진단 의료기기 산업 육성, 새로운 치료기회 확대를 기대할 수 있을 것"이라고 말했다.
한편, 체외진단의료기기법은 지난해 4월30일 의료기기법에서 분리해 별도로 제정됐다. 최근 진단 등 예방 중심으로 질병 패러다임이 변화하고, 일반 의료기기와 달리 혈액‧소변 등 검체를 대상으로 하는 체외진단 의료기기의 특성을 반영한 것이다. EU 등 주요 선진국도 이미 체외진단 의료기기에 대한 별도 법령체계를 운영하고 있다.
식약처, 코로나19 진단키트 등 안전관리 위한 체외진단의료기기법 시행
- 김새미 기자
입력 2020-05-01 13:50수정 2020-05-01 17:54
공유하기
기사 공유하기
체외진단의료기기 4등급으로 분류해 맞춤형 허가·심사 시행"체외진단의료기기 산업 육성, 새로운 치료기회 확대 기대"
관련기사
김새미 기자







![[단독] 삼성전자 외국인 보유율 50% 깨졌다 … 지난해 4월 ‘관세 공포’ 이래 최초](https://image.newdaily.co.kr/site/data/thumb/2026/03/06/2026030600254_0_thumb.jpg)