'Cas3 단백질'의 활성 조절 기전을 분자 수준에서 확인혁신 치료법인 유전자 가위의 DNA 편집 능력 향상 기대
-

- ▲ 박현호 교수(왼쪽)와 김도연 석사과정생.ⓒ중앙대
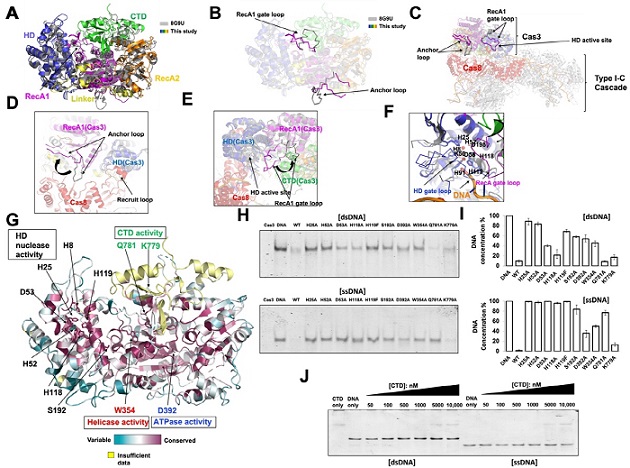
중앙대학교는 약학대학 박현호 교수 연구팀이 미래 혁신 치료법으로 주목받고 있는 유전자 가위의 핵심 단백질(Cas3) 구조를 세계 최초로 밝혔다고 3일 밝혔다. 연구팀은 또한 이를 기반으로 유전자 가위 단백질의 활성 조절 기전을 분자 수준에서 규명하는 데 성공했다.박테리아와 바이러스는 오랫동안 생존 경쟁을 벌여 왔다. 박테리아는 자신을 공격한 바이러스의 유전 정보를 기억했다가 유사한 유전자의 바이러스가 침투하면 즉각 제거하는 방식으로 자신을 보호한다. 이런 박테리아의 방어·면역 시스템을 유전자 가위 또는 크리스퍼-카스라 부른다.침투한 바이러스의 유전정보인 DNA를 자르는 단백질은 Cas3다. Cas3 단백질은 크리스퍼-카스 시스템에서 특정 서열의 DNA를 직접 자르는 역할을 한다. 미래 혁신 치료법으로 연구되는 유전자 가위의 핵심적인 단백질로 손꼽힌다. -
- ▲ Cas3의 활성 조절 기전 규명.ⓒ중앙대
박 교수와 김도연 석사과정생은 Cas3의 3차 구조 분석을 통해 Cas3가 활성화됐을 때와 비활성화 상태일 때의 구조를 비교했다. 연구팀은 어떤 구조적 변화를 통해 활성 여부가 조절되는지를 세계 최초로 밝혀냈다. 이번 연구성과는 특정 유전자 서열을 인식하고 잘라내 인간의 질병을 치료하는 데 활용되는 유전자 가위의 편집 능력을 높이는 데 큰 도움이 될 전망이다.박 교수는 "유전자 가위는 유전자 편집을 통해 인간의 질병을 치료할 혁신적인 치료법이지만, 유전자 가위의 효율, 정확성, 조절의 문제로 인해 아직은 불완전한 기술로 여겨진다"며 "특히 정상적인 DNA의 편집은 오히려 큰 문제를 일으킬 수 있어 활성 조절에 대한 연구가 선행돼야 한다"고 설명했다. 이어 "이번 연구성과는 Cas3의 활성 조절 기전을 분자 레벨에서 이해한 것으로, 유전자 가위를 정교하게 조절하고 응용하는 데 많은 도움이 될 것"이라고 했다.이번 연구 논문(3차 구조기반의 타입 I-C Cas3 활성 기전)은 생명과학 분야의 세계적 학술지 'Nucleic Acids Research'에 게재됐다. 이번 연구는 중견연구자지원사업과 두뇌한국21 플러스(BK21+) 사업의 지원을 받아 수행됐다. -

- ▲ 중앙대학교 전경. 우측 상단은 박상규 총장.ⓒ중앙대







