CARM1, RNA 가공·세포주기 조절 등 세포 내 비효소적 조절 기능 규명CARM1 과도하게 활성화되면 암세포 증식·전이 촉진하는 '가속 페달' 역할암 등 난치성 질환 겨냥한 차세대 표적치료제의 개발 방향 제시해 주목생화학·분자생물학 분야 국제학술지 '익스페리멘털 앤 몰레큘러 메디신'에 게재
-

- ▲ 숙명여대 약학대학 김용기 교수(왼쪽)와 조예나 석박통합과정.ⓒ숙명여대
숙명여자대학교는 약학대학 김용기 교수 연구팀이 유전자 발현을 조절하는 스위치 역할을 하는 단백질 아르기닌 메틸화 효소 'CARM1(Coactivator-associated arginine methyltransferase 1)'의 다면적인 기능을 종합적으로 분석하고, 이를 기반으로 새로운 치료 전략을 제시해 주목된다고 4일 밝혔다.CARM1은 1999년 처음 발견됐다. 주로 히스톤 메틸화에 의한 전사 조절 효소로 연구됐다. DNA(유전자 본체)를 감싸고 있는 단백질(히스톤)에 메틸기(-CH₃)라는 화학조각을 붙여 유전자가 얼마나 활발히 작동하는지를 조절하는 효소로 인식돼 왔다는 얘기다. 하지만 최근 연구에 따르면 CARM1은 히스톤뿐 아니라 여러 비히스톤 단백질에도 작용하며, 효소로서의 작용 외에도 단백질 간 결합을 돕는 '지지체(scaffold)' 기능을 수행한다. 이를 통해 유전자 발현 조절, 단백질 합성에 중요한 RNA(리보핵산) 가공, 에너지 대사, 세포주기 조절 등 세포 내 여러 과정에 폭넓게 관여하는 것으로 밝혀졌다.이번 연구는 이런 최근의 연구 성과들을 체계적으로 정리하며, CARM1이 단순한 효소가 아니라 핵과 세포질 전체의 신호 조절을 통합적으로 조정하는 '다기능 단백질'임을 제시했다. 특히 현재 개발된 CARM1 억제제들이 효소의 활성을 막는 데는 효과적이지만, 효소활성과는 무관한 지지체 기능까지는 억제하지 못한다는 점을 지적했다. -
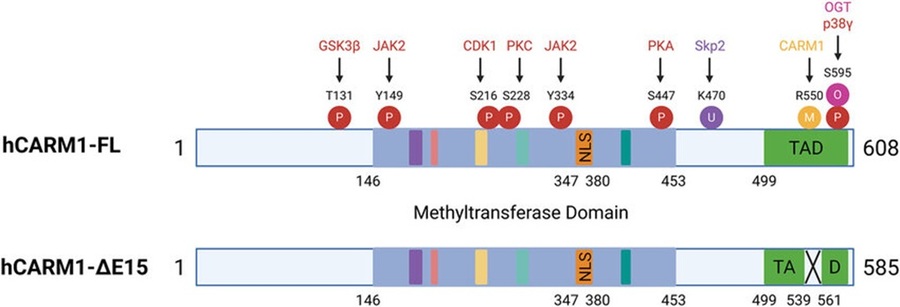
- ▲ CARM1의 구조와 그것이 세포 내에서 어떻게 조절되는지를 도식화한 그림.ⓒ숙명여대
연구팀은 CARM1 단백질 자체를 세포 내에서 제거하는 표적 단백질 분해 기술(PROTACs)을 새로운 치료 전략으로 제안했다. 이는 CARM1이 과도하게 활성화되면 암세포의 증식과 전이를 촉진하는 '가속 페달' 역할을 할 수 있다는 연구에 기반한 것으로, CARM1를 제거함으로써 암세포의 성장과 전이를 억제할 수 있다는 치료 전략을 제시한 것이다.김 교수는 "이번 연구는 CARM1의 비효소적 역할까지 함께 밝혀냄으로써 앞으로 암 등 난치성 질환을 겨냥한 차세대 표적 치료제 개발의 방향을 제시했다는 점에서 의미가 있다"고 설명했다.이번 연구 결과는 글로벌 출판사 스프링거 네이처에서 발간하는 의학 전문 학술지 '익스페리멘털 앤 몰레큘러 메디신(Experimental & Molecular Medicine·실험과 분자 의학)'에 지난달 29일 게재됐다. 약대 조예나 석박통합과정이 제1저자로 연구를 주도했다.이번 연구는 한국연구재단 선도연구센터(MRC), 기초연구사업(중견연구), 한-유럽연합(EU) 첨단바이오 글로벌 공동연구센터, 박사과정생 연구장려금 지원사업의 지원을 받아 수행됐다. -

- ▲ 숙명여자대학교 전경. 우측 하단은 문시연 총장.ⓒ숙명여대







