액적 세포 천공기(DCP) 플랫폼 개발기존 전기천공법보다 단일 유전자 제거 효율 6.5배 높아
-

- ▲ 왼쪽부터 고려대 바이오의공학부 정아람 교수, 고려대 생명공학부 정철희 교수, 공동 제1저자 윤다영 연구원, 제1저자 김유정 박사과정생.ⓒ고려대
고려대학교는 바이오의공학부 정아람 교수와 생명공학부 정철희 교수 공동 연구진이 액적(작은 물방울)을 활용한 신개념 미세 유체 플랫폼을 개발해 기존보다 효율이 월등히 높은 크리스퍼-캐스9(CRISPR-Cas9) 유전자 편집의 가능성을 열었다고 20일 밝혔다.크리스퍼-캐스9는 게놈 편집 기술 중 하나다. 게놈 편집 기술은 목표로 하는 유전자를 찾는 유전자 탐색기와 그 유전자를 자르는 유전자 가위로 구성된다. 기존의 1, 2세대 게놈 편집 기술은 정확도가 낮고 탐색기 제작이 어렵다는 문제가 있었다. 이를 극복하고 등장한 게 3세대 크리스퍼-캐스9 기술이다. 지난해 12월 3세대 크리스퍼-캐스9 기술을 활용한 첫 의약품(캐스게비·Casgevy®)이 미국 식품의약국(FDA) 승인을 받으면서 겸상적혈구병(SCD)과 베타지중해빈혈(TDT) 등의 치료에 새로운 지평을 열었다.캐스게비를 포함해 크리스퍼-캐스9의 전달은 보통 전기천공법을 활용한다. 전기천공법은 외부 물질을 세포 내로 도입하기 위해 전기충격을 주어 세포막에 일시적인 구멍을 만드는 방법이다. 그러나 이 기법은 고비용, 저효율의 단점과 함께 세포 안정성을 저해하는 한계가 있다. -
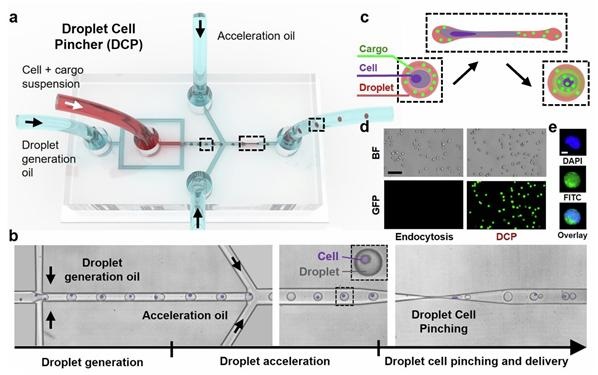
- ▲ a: DCP 플랫폼의 모식도. b: DCP 플랫폼의 실제 현미경 이미지. c: 액적 내 물질이 세포 내로 전달되는 메커니즘. d: DCP 플랫폼을 통한 전달 이후의 형광 이미지.ⓒ고려대
이에 고려대 연구팀은 액적 세포 천공기(DCP) 플랫폼을 개발해 고효율 유전자 편집을 실험했다.DCP 바이오칩은 미세 액적 내 유전자 편집 물질과 세포를 포획해 병목을 지나게 한다. 이 과정을 통해 세포막과 핵막이 열리면서 유전자 편집 물질이 기존 방법보다 효과적으로 세포 속에 전달된다. 이번 연구는 DCP 플랫폼을 사용해 메신저리보핵산(mRNA) 98%, 플라스미드(plasmid) DNA 91%의 고효율 형질 변환이 가능함을 증명했다.또한 DCP 플랫폼은 기존 전기천공법보다 6.5배의 단일 유전자 제거, 3.8배의 이중 유전자 제거와 유전자 삽입 효율을 보였다.연구를 이끈 정아람 교수는 "이번 연구는 그동안 낮은 효율로 활용 단계에서 제약이 있던 크리스퍼-캐스9 기반 유전자 편집 연구의 패러다임을 바꿀 가능성을 제시했다"고 말했다.제1저자인 김유정 연구원은 "현재 DCP 플랫폼을 이용해 인간 일차 면역세포 내로 물질을 전달하는 후속 연구를 진행 중이다. 크리스퍼-캐스9 외에도 베이스 에디터(base editor)와 같은 4세대 유전자 편집기를 전달해 세포 치료제 개발과 실용화에 도움이 되고 싶다"고 포부를 밝혔다.이번 연구 논문(Highly efficient CRISPR-mediated genome editing through microfluidic droplet cell mechanoporation)은 싱가포르 국립대학의 이정준 교수와 공동연구로 진행했으며 지난 16일 국제 저명 학술지 '네이처 커뮤니케이션스'에 게재됐다.이번 연구는 한국연구재단 개인연구사업(중견), 미래유망융합기술파이오니어, 선도연구센터 사업의 지원을 받아 수행했다. -

- ▲ ⓒ고려대







