'진파인더', RT-PCR 방식 진단키트… 미국 시장 본격 진출 가능외교부 발표 美 FDA 사전승인 받은 국내 업체 2곳 소식은 '아직'
-
- ▲ 오상헬스케어의 코로나19 진단키트 ⓒ오상헬스케어
오상자이엘의 자회사인 오상헬스케어가 국내 최초로 미국 식품의약국(FDA)의 '긴급사용승인(EUA, Emergency Use Authorization)'을 획득했다.
19일 FDA 공식 홈페이지를 살펴보면, 오상헬스케어의 신종 코로나바이러스 감염증(이하 코로나19) 진단키트 '진파인더(GeneFinder COVID-19 Plus RealAmp Kit)'가 긴급사용승인 허가 명단에 게재돼 있다. -
해당 진단키트는 실시간 유전자 증폭(RT-PCR) 방식으로 코로나19 감염 여부를 진단한다. 오상헬스케어는 이번 긴급사용승인 획득을 통해 본격적인 미국 시장 진출이 가능해졌다.
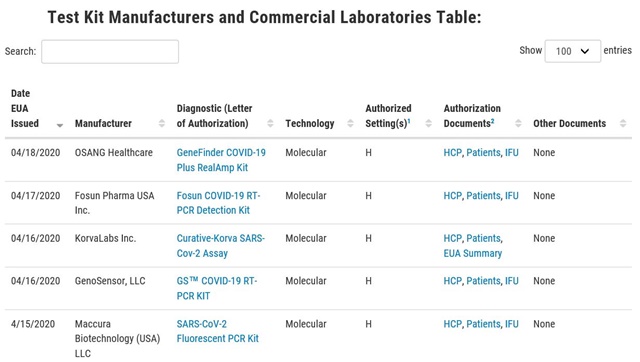
- ▲ 미국 식품의약국(FDA) 공식 홈페이지의 코로나19 진단키트 긴급사용승인(EUA) 허가 리스트 ⓒFDA 홈페이지 캡쳐
현재까지 국내 진단키트 업체 중 FDA 긴급사용승인을 받은 곳은 오상헬스케어가 유일하다.
앞서 외교부는 지난달 말 국내 업체 3곳의 제품이 FDA의 긴급사용승인 절차상 '사전 승인'을 획득했다고 발표했다가 '잠정 승인'을 받은 것이라고 말을 바꾼 바 있다.
또한, 미국 CNN은 지난 15일 SD바이오센서, 솔젠트, 오상헬스케어 등 국내 업체 3곳이 1140만 달러 규모의 코로나19 진단키트 수출 계약을 미국 연방재난관리청(FEMA)과 체결하고 물품을 선적했다고 보도한 바 있다.







