-
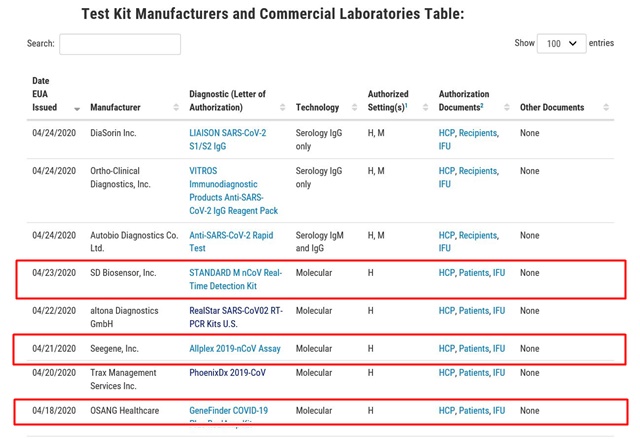
- ▲ 미국 식품의약국(FDA) 공식 홈페이지의 코로나19 진단키트 긴급사용승인(EUA) 허가 리스트 ⓒFDA 공식홈페이지 캡쳐
국산 코로나19 진단키트가 미국 식품의약국(FDA)의 긴급사용승인(EUA)을 잇달아 획득하면서 수출길이 활짝 열렸다.
27일 업계에 따르면 오상헬스케어, 씨젠에 이어 에스디바이오센서(이하 SD바이오센서)가 지난 23일(현지시간) FDA의 긴급사용승인을 획득했다.
FDA의 긴급사용승인을 받은 코로나19 진단키트는 오상헬스케어의 '진파인더(GeneFinder COVID-19 Plus RealAmp Kit)', 씨젠의 '올플렉스 코로나19 에세이(AllplexTM 2019-nCoV Assay)', SD바이오센서의 '스탠다드 M(STANDARD M nCoV Real-Time Detection Kit)'이다. 해당 제품들은 미국 전역에서 자유롭게 사용할 수 있게 됐다.
해당 제품은 모두 실시간 유전자 증폭(RT-PCR) 검사법을 활용한 진단키트로, 오상헬스케어를 제외한 2개사는 질병관리본부(이하 질본)의 긴급사용승인을 받은 바 있다. 질본의 긴급사용승인을 받은 업체는 코젠바이오텍, 씨젠, 솔젠트, SD바이오센서, 바이오세움 등 5개사다.
그간 FDA의 긴급사용승인을 획득하지 못한 국내 진단업체들은 주(州)정부에 제한적으로 공급하는 방식으로 미국에 진단키트를 공급해왔다. 주 정부가 관리하는 진단검사회사(CLIA Laboratory)의 검증 절차를 통해 미국 시장에 우회적으로 들어서는 방식이다.
씨젠의 경우 미국에서 로스앤젤레스(LA) 시의회와 LA 카운티가 진단키트 2만개를 125만 달러(약 15억 3800만원)에 구매하겠다고 발표한 바 있다.
솔젠트는 이원다이애그노믹스(EDGC)의 자회사인 EDGC 헬스케어를 통해 미국 콜로라도주정부에 코로나19 진단키트 초도 물량 10만명분을 지난 21일 긴급 수송했다. 솔젠트는 EDGC를 통해 지난달 25일 콜로라도 외에도 뉴욕, 캘리포니아, 네바다 등 미국 다수의 주정부와 코로나19 진단키트 100만명분 구매의향서(LOI)를 체결한 바 있다.
코로나19 항체진단키트의 경우 FDA 제품 등록만으로도 미국내 공급이 가능하다. 지난 6일에는 수젠텍과 바디텍메드, 지난 20일에는 휴마시스가 코로나19 항체진단키트로 FDA의 등록을 통해 미국 각 주 정부에 공급할 수 있는 자격을 얻었다. 다만, 항체진단키트는 주별 허가 정책에 따라 공급되기 때문에 미국 전역을 포괄하는 연방정부 차원의 절차와 다르다.
FDA가 국산 코로나19 항체진단키트에 대해 긴급사용승인을 내려줄 가능성도 배제할 수는 없다.
항체 진단 방식은 특별한 실험실이 필요 없어 전문가가 아니어도 누구나 실시할 수 있고, RT-PCR 방식에 비해 검사 시간이 15~20분 정도로 짧다. FDA도 RT-PCR 방식의 코로나19 진단키트들만 긴급사용승인을 해오다 지난 1일 셀렉스(Cellex)의 항체진단키트에 대해 긴급사용승인을 내준 이후 셀렉스를 포함한 4개사에 승인을 내줬다.
앞으로 국산 코로나19 진단키트가 추가적으로 FDA의 문턱을 넘을지도 기대된다. 코젠바이오텍, 솔젠트, 랩지노믹스, 진매트릭스 등도 FDA에 긴급사용승인을 신청한 상태다.
이 중 한 업체의 관계자는 "FDA의 긴급사용승인 허가 소식을 기다리는 중"이라며 "그와 별도로 이미 해외 각국의 발주 물량이 밀려있는 상태라 매우 분주한 상태"라고 말했다.
국산 코로나19 진단키트 美 FDA 긴급사용승인 3개사 확정… 추가 승인도 '기대'
- 김새미 기자
입력 2020-04-27 15:01수정 2020-04-27 15:30
공유하기
기사 공유하기
오상헬스케어·씨젠·SD바이오센서 등 3개사 제품, 美 전역서 자유롭게 사용코젠바이오텍, 솔젠트 등 국산 코로나19 진단키트, 추가 FDA 승인 기대감↑
관련기사
김새미 기자







