단순 약물운반체 기능에서 '능동형 치료제'로 탈바꿈콜레스테롤을 방사선에 반응해 활성산소 증폭하는 물질로 대체방사선 쬐면 활성산소가 암세포 방어막 무력화해 사멸 유도암 조직 성장 억제·면역세포 활성화 … 암세포 전이도 현저히 감소생체재료 분야 세계적 권위지 '바이오머티리얼즈'에 게재
-

- ▲ 왼쪽부터 성균관대 융합생명공학과 박우람 교수, 신승용 박사과정생, 배가현 박사과정생.ⓒ성균관대
성균관대학교는 융합생명공학과 박우람 교수 연구팀이 방사선에 반응해 암세포를 공격하는 '방사선 활성화형 지질 나노입자(Radio-activatable Lipid Nanoparticle, 이하 RaLNP)'를 개발했다고 28일 밝혔다.이번 연구는 단순한 약물 운반체에 불과했던 지질 나노입자(LNP)의 한계를 뛰어넘어 전달체 자체가 암세포를 공격하는 '능동적 치료제'로 진화했다는 점에서 차세대 방사선 치료의 새로운 패러다임을 제시했다는 평가다.기존의 지질 나노입자는 코로나19 백신 등을 통해 널리 알려진 약물 전달 기술로, 핵심 성분인 콜레스테롤이 입자의 구조를 유지하는 역할을 한다. 연구팀은 이 콜레스테롤을 방사선에 반응해 활성산소를 증폭하는 물질인 '7-디하이드로콜레스테롤(7-DHC)'로 대체하는 혁신적인 전략을 세웠다. 이를 통해 방사선을 쬐는 특정 부위에서만 입자가 활성화돼 치료 효과를 극대화할 수 있는 토대를 마련했다. -
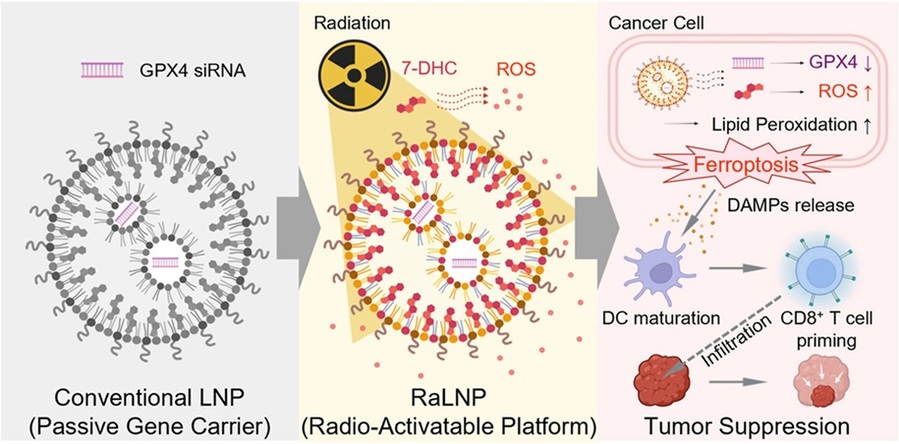
- ▲ 방사선 활성화형 지질 나노입자(RaLNP)를 이용한 방사선 치료 효과 증진.ⓒ성균관대
연구팀이 개발한 RaLNP는 암세포를 스스로 죽게 만드는 '페롭토시스(Ferroptosis)' 현상을 강력하게 유도한다. 페롭토시스는 과도한 활성산소에 의해 세포막을 이루는 지방 성분(인지질)이 산화돼 세포가 사멸하는 현상이다. RaLNP는 두 가지 공격 전략을 펼친다. 우선 암세포가 활성산소로부터 자신을 보호하기 위해 사용하는 'GPX4'라는 방패(유전자)를 무력화하는 물질(siRNA)을 암세포 내부로 전달한다. 이와 함께 입자를 구성하는 7-DHC 성분이 방사선과 만나 활성산소를 대폭 증폭해 암세포에 치명적인 타격을 입힌다.연구팀은 유방암을 이식한 실험 쥐에 RaLNP를 투여하고 방사선을 조사한 결과, 암 조직의 성장이 눈에 띄게 억제됐을 뿐만 아니라 면역세포(수지상 세포, T세포)의 활성화를 유도하는 것을 확인했다. 이런 면역 반응과 함께 폐나 간으로 암세포가 퍼지는 전이 현상도 현저히 감소했다. 이는 방사선 치료가 면역 반응과 연계돼 전신 항암 효과로 확장될 가능성을 시사한다.그동안 방사선 치료의 효율을 높이기 위해 사용되던 '방사선 민감제'들은 전신 독성을 나타내거나 부작용을 일으키는 경우가 많았다. 이번에 개발된 RaLNP는 방사선이 없는 상태에서는 독성을 띠지 않는 비활성 상태를 유지하다가 정밀하게 조준된 방사선을 만날 때만 강력한 항암 효과를 발휘한다. 이는 환자가 겪을 부작용을 획기적으로 줄이면서 치료 효과는 극대화할 수 있는 새로운 대안이 될 것으로 기대된다.박우람 교수는 "이번 연구는 수동적인 약물 전달체였던 지질 나노입자를 방사선에 의해 활성화되는 능동적인 치료제로 진화시킨 중요한 도약"이라며 "앞으로 난치성 암 환자의 방사선 치료 효과를 높이고, 전이암까지 효과적으로 억제할 수 있는 차세대 치료 플랫폼 기술로 활용되길 바란다"고 말했다.이번 연구 논문은 생체재료 분야의 세계적 권위지인 '바이오머티리얼즈(Biomaterials·생체재료)'에 지난 12일 온라인 게재됐다. 성균관대 신승용, 배가현 박사과정생이 공동 제1저자로 참여했다.이번 연구는 한국연구재단, 범부처재생의료기술개발사업, 한국기초과학지원연구원의 지원을 받아 수행됐다. -

- ▲ 성균관대학교 전경. 좌측 상단은 유지범 총장.ⓒ성균관대







