-
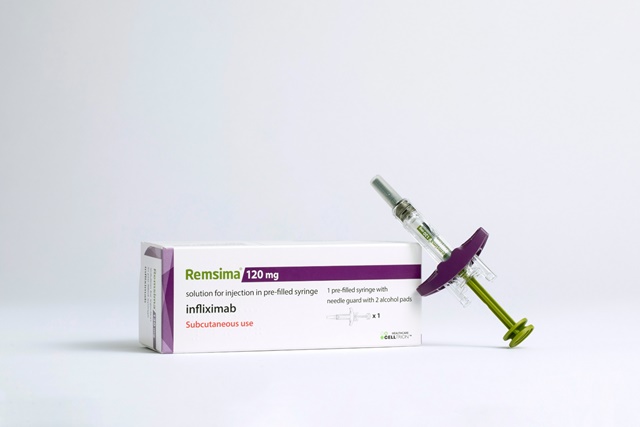
- ▲ 램시마SC PFS-S ⓒ셀트리온
셀트리온은 자체 개발한 항체 바이오의약품 '램시마SC'가 식품의약품안전처(이하 식약처)로부터 국내 판매허가를 받았다고 26일 밝혔다.
셀트리온은 TNF-α 억제제(자가면역질환 치료제) 시장에서 경쟁력을 확보하기 위해 기존 정맥주사(IV) 제형인 램시마를 피하주사(SC) 제형으로 변경한 최초의 인플릭시맙 치료제 램시마SC를 개발했다. 램시마SC는 지난해 11월 유럽의약품청(EMA)으로부터 판매 승인을 획득하고, 이달 독일을 시작으로 유럽시장에 첫 선을 보였다.
이번에 식약처로부터 허가 받은 적응증은 류마티스 관절염(RA) 적응증이다. 셀트리온은 염증성 장질환(IBD) 적응증 추가 허가까지 완료되면 국내 시장에 램시마SC를 론칭할 예정이다.
셀트리온은 최근 북미 시장 진출을 위해 캐나다에 램시마SC 허가 신청을 제출한 바 있다. 허가 후에는 셀트리온헬스케어 직판망을 통해 캐나다 전역에 공급할 계획이다.
세계 최대 바이오의약품인 시장 미국에서는 램시마SC를 '신약'으로 인정해 1·2상 임상을 면제받고 현재 3상 임상을 진행 중이다. 셀트리온은 오는 2022년 미국 식품의약국(FDA) 허가를 목표로 하고 있다.
셀트리온 관계자는 "이번 램시마SC 식약처 허가에 따라 셀트리온은 국내에서도 자가면역질환 치료제 시장에서 강력한 포트폴리오를 갖추게 됐다"며 "램시마SC를 국내 환자들에게 조기에 선보일 수 있도록 IBD 적응증 확보에도 최선을 다하겠다"고 말했다.
한편, 시장조사기관 아이큐비아에 따르면 램시마는 국내 시장에서 지난해 상반기 기준으로 시장점유율을 36%까지 확대해 오리지널 의약품 시장의 대체율 40% 돌파를 앞두고 있다. 같은 기간 트룩시마와 허쥬마도 각각 20%, 22%의 시장점유율을 확보한 상태다.
셀트리온 '램시마SC' 국내 판매 허가… 류마티스관절염 적응증 승인
- 김새미 기자
입력 2020-02-26 08:41수정 2020-02-26 08:48
공유하기
기사 공유하기
염증성 장질환 적응증 추가 후 국내 시장 론칭 예정지난해 11월 EMA 허가 이은 식약처 허가… 캐나다 허가 신청
관련기사
김새미 기자







![李 대통령 '분당 집' 처분 않기로 … '비거주 1주택자', 세금 중과 예외 넓어지나 [N-경제포커스]](https://image.newdaily.co.kr/site/data/thumb/2026/02/15/2026021500018_0_thumb.jpg)