-
- ▲ 식품의약품안전처는 신속한 코로나19 치료제·백신 개발을 위해 '고강도 신속 제품화 촉진 프로그램(고(GO)·신속 프로그램)'을 마련·운영한다. ⓒ식품의약품안전처
식품의약품안전처(이하 식약처)가 신종 코로나바이러스감염증-19(이하 코로나19) 치료제·백신 임상시험 심사기간을 15일 이내로 획기적으로 단축하기로 했다.
식약처는 신속한 코로나19 치료제·백신 개발을 위해 '고강도 신속 제품화 촉진 프로그램(고(GO)·신속 프로그램)'을 마련·운영한다고 13일 밝혔다.
이번 프로그램은 코로나19 치료제·백신 개발을 앞당겨 국제적으로 치열한 경쟁에서 국가 경쟁력을 확보하기 위해 마련됐다.
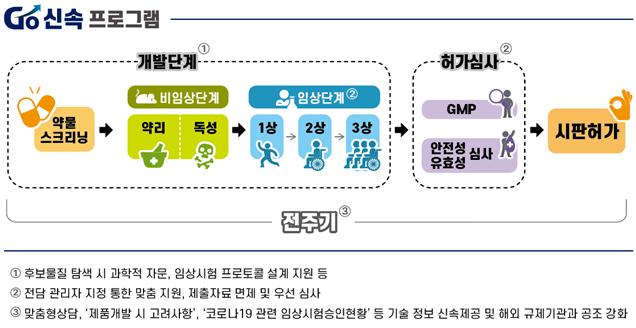
고(Go)·신속프로그램은 연구개발·임상승인·허가심사·정보공유·국제공조에 대한 지원 전략을 통해 개발 기간을 단축하는 것을 골자로 하고 있다.
식약처는 연구 지원을 위해 정부·출연연구소가 진행하는 후보물질 탐색 시 제품화 가능성 있는 물질을 결정하기 위한 과학적 자문을 제공하한다. 개발자들이 제품 효능평가 시 활용할 수 있도록 코로나 19 바이러스 감염 동물모델을 개발·공유하고 치료제·백신 임상프로토콜 개발 등을 지원한다.
식약처는 연구개발부터 허가심사 전 단계에 걸친 ‘코로나 19 전담 상담창구’를 개설한다. 치료효과를 기대할 수 있는 품목에 대한 전담관리자(Project Manager)를 지정해 개발 단계별로 맞춤 지원한다.
안전성이 입증된 플랫폼을 사용하여 개발한 백신은 독성시험을 면제한다. 식약처는 코로나19 관련 의약품에 대한 자료 제출을 최소화해 임상 진입을 도울 계획이다.
경험 있는 심사자로 구성된 심사팀을 운영해 사용 경험이 있는 물질의 경우 7일 이내, 신물질의 경우 15일 이내로 임상시험 심사기간을 획기적으로 단축한다. 허가 시에도 우선적으로 신속 처리할 방침이다.
또한, 임상시험 설계 방법 등의 내용을 담은 ‘코로나19 치료제 개발 시 고려사항’ 정보를 제공하고, 임상시험 승인현황을 신속히 공개할 예정이다. 의약품 규제기관 국제 연합(ICMRA) 등 국제적 공조를 통해 각국에서 진행되는 임상시험·심사정보를 공유하고 제품화지원팀장과 핫라인을 설치·운영한다.
식약처 관계자는 "정부 관계 기관을 비롯해 산업계, 학계, 연구소, 병원 등과 협력해 안전하고 효과 있는 치료제와 백신을 신속히 개발할 수 있도록 최선을 다하겠다"고 말했다.
식약처 "코로나19 치료제·백신 임상 심사 기간, 15일 이내로 단축"
- 김새미 기자
입력 2020-04-13 15:29수정 2020-04-13 15:31
공유하기
기사 공유하기
코로나19 치료제·백신 개발 기간 단축 위해 고(GO)·신속 프로그램 운영
관련기사
김새미 기자







