지방세포 내부 자연적 분해 경로인 CMA를 정밀하게 활성화하는 플랫폼 제시간·신장 기능 등 독성 지표에 이상 없어 국소적·정밀 치료전략 가능성 보여서울대·고려대·한국재료연구원과 공동 연구 … 대사·노화 관련 질환으로 확장 가능성재료과학 분야 국제학술지 '어드밴스드 머티리얼즈'에 게재
-

- ▲ 변준호 교수.ⓒ숙명여대
숙명여자대학교는 약학부 변준호 교수 연구팀이 빛 자극을 이용해 지방세포에서만 선택적으로 지방을 분해하는 새로운 나노기반 비만 치료 전략을 개발했다고 16일 밝혔다.이번 연구는 비만의 치료 안정성과 정밀성을 높이는 한편, 다양한 대사 질환과 노화 관련 질환으로 확장될 가능성을 함께 보여줘 주목된다.비만은 전 세계적으로 가장 흔한 만성 질환 중 하나다. 당뇨병·심혈관 질환·지방간 등 다양한 대사 질환의 주요 원인으로 알려져 있다. 현재 비만 치료는 약물이나 수술에 의존한다. 하지만 전신 부작용이나 침습성 등의 한계가 있어 더 안전하고 정밀한 치료법에 대한 요구가 커지고 있다.연구팀은 지방세포 내부의 자연적 분해 경로인 '샤페론 매개 자가포식'(Chaperone-Mediated Autophagy, CMA)을 빛을 쬐어 선택적으로 활성화하는 나노플랫폼을 제안했다. CMA는 특정 단백질을 리소좀으로 전달해 분해하는 세포 내 항상성 유지 기작이다. 최근 지방 분해와의 밀접한 관련성이 밝혀지며 새로운 치료 타깃으로 주목받고 있다. -
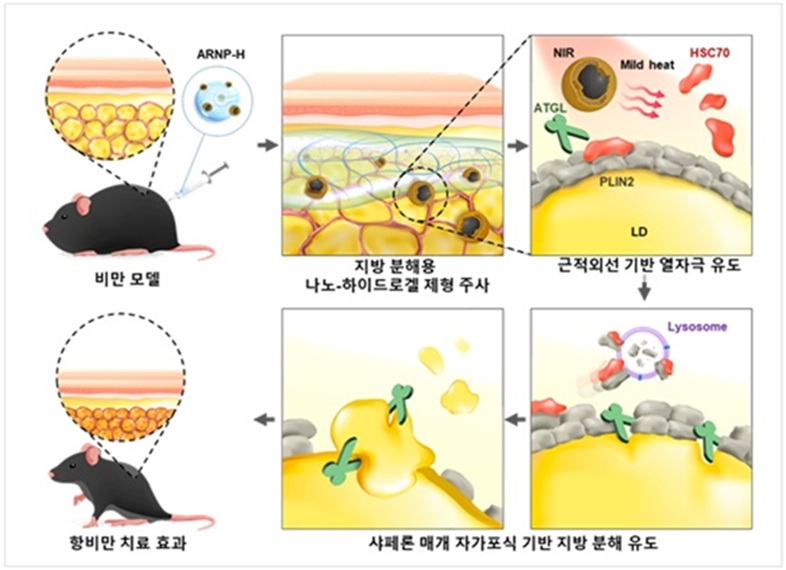
- ▲ 근적외선 감응형 나노-하이드로겔을 치료제로 하는 자가포식 기반 항비만 치료 모식도.ⓒ숙명여대
이번에 개발된 시스템은 지방세포 막으로 코팅된 폴리도파민 기반 나노입자에 지방 분해를 촉진하는 약물을 탑재하고, 이를 하이드로겔에 삽입한 형태(ARNP-H)다. 이 나노입자는 지방세포 고유의 막 성분을 이용해 다른 면역세포나 주변 세포가 아닌 지방세포에 선택적으로 흡수되도록 설계된 것이 특징이다.특히 근적외선 빛을 내리쬐면 나노입자가 약한 열 자극을 발생시키고, 이를 통해 CMA의 핵심 단백질인 'HSC70'이 활성화된다. 그 결과 지방 방울을 보호하던 단백질(PLIN2)이 분해되고, 지방 분해 효소가 지방 방울에 접근할 수 있게 되면서 지방세포에서만 지방 분해가 유도된다.동물실험 결과, 고지방 식이를 통해 비만이 유도된 쥐 모델에서 해당 나노-하이드로겔 제형을 적용한 뒤 빛을 비췄을 때 체중이 유의하게 줄고, 지방 조직의 크기와 중성지방 축적이 현저히 줄어드는 효과를 확인했다.또한 간과 신장 기능 등 주요 독성 지표에서는 이상이 관찰되지 않아 국소적·정밀 치료전략으로서 가능성을 보였다.변 교수는 "이번 연구는 지방세포를 직접 제거하거나 손상하는 기존 광열 치료와 달리 세포의 자연적 분해 시스템을 정밀하게 조절해 지방만 선택적으로 분해하는 새로운 개념의 비만 치료 전략을 제시한 것"이라며 "앞으로 비만뿐 아니라 자가포식 기능 이상과 관련된 다양한 대사질환과 노화 관련 질환에도 적용할 가능성을 검증해 나갈 계획"이라고 말했다.이번 연구 성과는 재료과학·나노바이오 분야의 세계적 학술지 '어드밴스드 머티리얼즈(Advanced Materials·첨단 소재)'에 지난 8월 게재됐다. 이번 연구는 서울대, 고려대, 한국재료연구원 연구진과 함께 수행했다. -

- ▲ 숙명여자대학교 전경. 우측 하단은 문시연 총장.ⓒ숙명여대







