히스톤 메틸화 효소 'CARM1' 중심의 세포 내 튜불린 항상성 원리 정립암·신경퇴행성 질환의 차세대 치료 전략에 대한 이론적 기반 제공생화학·분자생물학 분야 국제학술지 '익스페리멘털 앤 몰레큘러 메디신'에 게재
-

- ▲ 숙명여대 약학대학 김용기 교수(왼쪽)와 조예나 석박통합과정.ⓒ숙명여대
숙명여자대학교는 약학대학 김용기 교수 연구팀이 주요 구조 단백질인 튜불린의 자가조절 메커니즘(생성 조절 과정) 핵심 조절 축으로 CARM1-PI3KC2α 신호축을 제시했다고 13일 밝혔다.미세소관 이상과 연관된 암, 신경퇴행성 질환 등을 표적으로 하는 차세대 치료 전략의 이론적 기반이 될 것으로 기대된다.튜불린은 세포 내 미세한 관상 구조물을 구성하는 주요 단백질로, 세포 형태 유지, 세포 내 수송, 세포분열에 필수적이다. 세포 내 농도의 미세한 불균형만으로도 세포 기능 이상과 다양한 질환을 유발할 수 있다. 튜불린의 세포 내 항상성 유지 원리는 지난 40여 년간 해답을 찾지 못한 난제로 남아 있었다. -
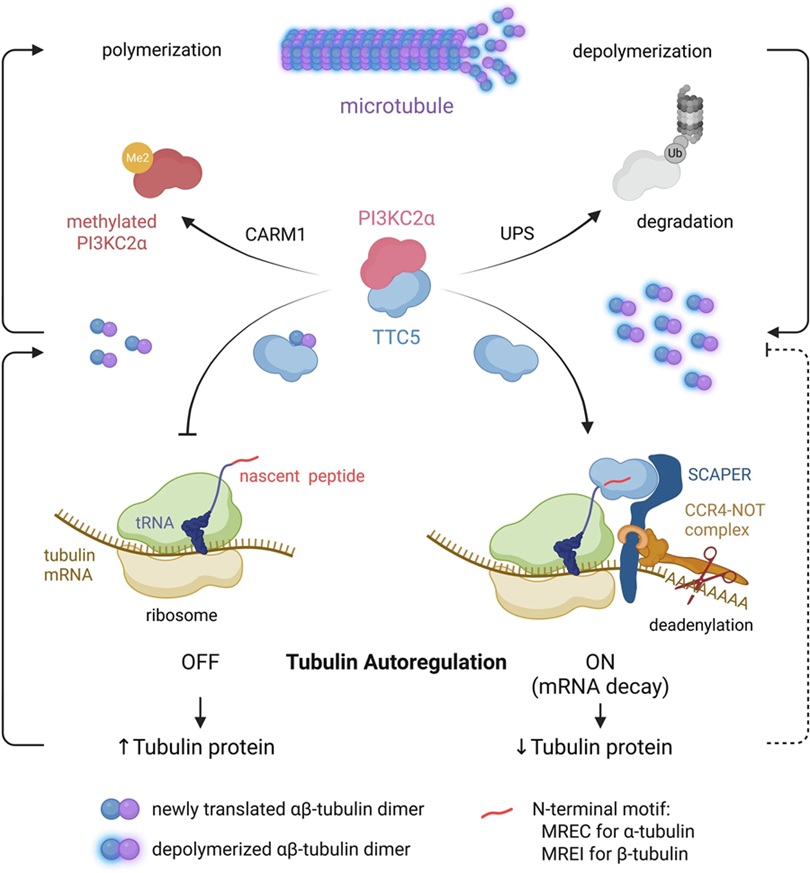
- ▲ CARM1–PI3KC2α–TTC5 신호 전달 축을 통한 튜불린 자가 조절의 기전 모델.ⓒ숙명여대
이번 연구는 튜불린 mRNA(메신저 리보핵산)가 번역되는 동시에 선택적으로 분해되는 공번역적 mRNA 분해(co-translational mRNA decay)라는 자가조절 메커니즘에 주목하고, 이 과정이 TTC5에 의해 매개되며 CARM1-PI3KC2α 신호축에 의해 정밀하게 제어된다는 사실을 밝혀냈다.특히 단백질 번역, 리보솜 연관 품질 관리, 번역 후 단백질 수식 과정이 서로 분리된 현상이 아니라 하나의 통합된 조절 네트워크로 작동한다는 것을 규명했다. 이를 통해 CARM1이 기존에 알려진 히스톤 메틸화 효소의 역할을 넘어 세포질에서 튜불린 항상성을 직접 조절하는 핵심 인자임을 강조했다.아울러 연구팀은 액틴 단백질이 ZBP1에 의한 mRNA 위치 조절과 G-actin-MRTF/SRF 전사 피드백 회로를 통해 튜불린과는 다른 방식의 자가조절 전략을 사용한다는 점을 밝혀냈다. 이는 세포골격 단백질들이 각기 다른 조절 회로를 통해 항상성을 유지한다는 점을 보여준다.김 교수는 "이번 연구는 지난 40여 년간 명확히 규명되지 않았던 튜불린 자가조절 메커니즘을 CARM1을 중심으로, 체계적으로 규명했다는 점에서 의미가 매우 크다"고 설명했다.이번 연구 결과는 글로벌 출판사 스프링어 네이처에서 발간하는 의학 전문 학술지 '익스페리멘털 앤 몰레큘러 메디신(Experimental & Molecular Medicine·실험과 분자 의학)'에 지난 8일 게재됐다. 약대 조예나 석·박사통합과정이 제1저자로 연구를 주도했다.이번 연구는 한국연구재단 선도연구센터(MRC), 기초연구사업(중견연구), 한-EU 첨단바이오 글로벌 공동연구센터, 박사과정생 연구장려금 지원사업의 지원을 받아 수행됐다. -

- ▲ 숙명여자대학교 전경. 좌측 하단은 문시연 총장.ⓒ숙명여대







