-

- ▲ 김선영 헬릭스미스 대표는 24일 오전 서울 여의도 NH투자증권 본사에서 설명회를 개최했다. ⓒ박성원 기자
"한 번에 임상 3상을 성공시키지 못해 죄송하다. 약물 혼용이라는 어이없는 사건이 벌어질 것을 전혀 예상하지 못했다. 향후 임상에서는 이런 일이 없도록 철저히 진행하겠다."
김선영 헬릭스미스 대표는 24일 오전 8시30분 서울 여의도 NH투자증권 본사에서 열린 설명회에서 이같이 말했다.
앞서 헬릭스미스는 지난 23일 당뇨병성 신경병증 유전자치료제 '엔젠시스(VM202)' 임상 3a상 데이터를 분석한 결과, 위약과 약물의 혼용 가능성이 발견됐다고 밝힌 바 있다. 이에 따라 최종 결론 도출은 임상 3b상 이후로 연기된다.
이번주 내에 발표될 예정이었던 당뇨병성 신경병증 유전자치료제 '엔젠시스(VM202)' 임상 3상 결과 공개가 지연됐다. 헬릭스미스는 후속 임상시험을 진행해 오는 2022년 하반기에 품목허가신청서(BLA) 제출을 목표로 하고 있다.
특히 대규모로 진행했던 임상 3a상과 달리 후속 임상은 150~160명 규모로 줄여서 2~3개를 진행하겠다는 계획이다. 소규모 임상으로 쪼개서 철저히 관리함으로써 데이터의 품질을 높이겠다는 것. 임상 3b상들은 향후 6개월 내에 시작해 오는 2021년 말~2022년 1분기 내에 모두 종료할 예정이다.
김 대표는 "약물에 대한 자신감이 워낙 강했고, 빨리 시판허가를 받겠다는 목표 때문에 대규모로 임상을 2개 추진했었는데 (이번 임상 3a상에서) 이런 결과가 나왔기 때문에 후속 임상 3상은 2~3개로 나눠서 효율적으로 하겠다"고 설명했다. -
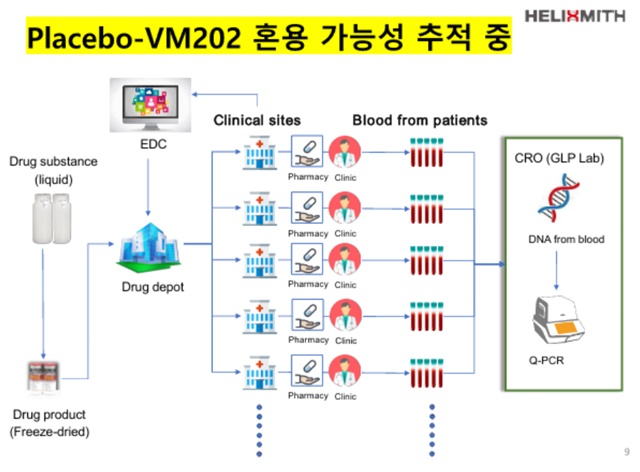
- ▲ 헬릭스미스는 약물 혼용 원인에 대해 추적 조사 중이다. ⓒ헬릭스미스
헬릭스미스는 약물 혼용 원인에 대해 추적 조사 중이며, 소송도 불사할 계획이다. 회사 측에서는 CRO기관보다는 임상의료기관에서 혼용 문제가 발생했을 가능성이 높을 것으로 보고 있다.
김 대표는 "복수의 임상 사이트에서 (위약과 엔젠시스를) 바꿔 썼을 가능성에 의혹을 갖고 있다"며 "총 25개의 임상사이트가 운영됐는데, 어떤 사이트는 우수하게 관리한 반면 일부 작은 사이트에서는 기준을 제대로 따르지 않았다"고 언급했다.
그러면서도 김 대표는 "문제가 된 피험자를 제외할 때에는 긍정적인 시그널이 나왔다"고 주장했다.
헬릭스미스는 최소 32명의 명백하게 오류가 있는 환자들을 제거하고 분석하면, 통계적으로 유의한 차이가 발생한다고 밝혔다. 특히 등록 환자수가 많고 데이터 품질이 우수한 임상의료기관에서는 통증 감소 효과가 더욱 강력하게 나타났다는 것이다.
다만, 이는 환자를 선별해 분석한 것이기 때문에 엔젠시스의 약효를 담보하는 것은 아니다. FDA에서도 이 같은 분석 결과에 대해 인정하진 않을 것으로 보인다. -

- ▲ 김선영 헬릭스미스 대표는 24일 오전 서울 여의도 NH투자증권 본사에서 설명회를 개최했다. ⓒ박성원 기자
이번에 임상의 품질 보증 문제에 대한 중요성이 크게 대두된 만큼, 임상 품질 전문가 랜 피서 박사를 단장으로 조사단을 꾸려 철저히 조사에 임하겠다는 게 김 대표의 복안이다.
김 대표는 "임상의 품질 보증에 대한 중요성이 크게 대두됐다"며 "마침 4주 전에 레너드 피쉬(Leonard Fish) 박사를 영입했기 때문에 그를 단장으로 한 조사단을 꾸렸다"고 말했다.
헬릭스미스는 임상품질(Clinical QA) 전문가인 레너드 피쉬 박사를 단장으로 하는 조사단을 구성해 정밀 조사에 착수했다. 추후 법적 조치 가능성을 고려해 명확한 결론이 도달할 때까지 해당 조사는 비공개로 진행할 예정이다.
또한, 헬릭스미스는 향후 엔젠시스의 라이선스아웃에 대한 가능성도 열어뒀다. 이날 설명회에 참석한 주주들은 회사 측이 눈높이를 낮춰서라도 적극적으로 라이선스아웃을 추진할 것을 요구했다. 이에 회사 측은 내부적으로 검토 중이라고 답했다,
김 대표는 "지금의 문제를 교훈으로 삼아 후속 임상 3상은 성공적으로 이끌겠다"며 "임상이 끝나면 즉시 BLA를 제출할 수 있도록 최선을 다하겠다"고 강조했다.
한편, 이날 헬릭스미스의 주가는 전일 대비 5만 1400원(29.99%) 하락한 12만원으로 하한가를 기록했다.
헬릭스미스 "임상 중 약물 혼용 가능성 죄송… '엔젠시스' 후속 임상 진행"
- 김새미 기자
입력 2019-09-24 12:13수정 2019-09-24 12:36
공유하기
기사 공유하기
헬릭스미스, 24일 오전 서울 여의도 NH투자증권 본사서 기업설명회약물 혼용 원인에 대해 추적 조사 중… 문제 원인 확정 시 소송 계획"명백한 오류 있는 환자 제거해 분석 시 유의한 통증감소 효과 보여"
관련기사
김새미 기자







