KRASG13D 변이 대장암, 1차 치료제 세툭시맙 효과 떨어져약물 반응성 떨어지는 'HER2–ELF3–KRAS 축' 세계 최초 규명동물실험에서 항암 효과 입증 … 정밀 맞춤형 치료 가능성 열어국제 저명 학술지 '분자암'에 게재
-

- ▲ 이화여대 권영주 교수(왼쪽)와 황수연 박사(제1저자).ⓒ이화여대
이화여자대학교는 약학과 권영주 교수 연구팀이 기존 항암 치료에 반응하지 않던 KRAS G13D 변이 대장암에서 암세포의 생존과 증식을 매개하는 핵심 신호 경로를 세계 최초로 규명했다고 2일 밝혔다. 기존 치료에 효과가 없었던 대장암 환자에게 새로운 맞춤형 치료 전략을 제시했다는 점에서 정밀의료 분야의 중요한 이정표로 주목받는다.현재 대장암 환자의 최대 80%는 EGFR 단백질이 과도하게 만들어지는 현상을 보인다. 이에 따라 EGFR을 억제하는 세툭시맙(Cetuximab)이 1차 치료제로 사용된다. 그러나 KRAS나 BRAF 유전자에 변이가 있는 환자에게는 세툭시맙의 치료 효과가 급격히 떨어진다. 그중에서도 KRAS G13D 유전자 변이를 가진 환자는 대장암 예후가 특히 나쁘다. 하지만 그동안 연구는 주로 다른 유전자 변이에 집중돼 있어 KRAS G13D 대장암 환자를 위한 치료 전략 개발이 시급했다.권 교수 연구팀은 KRAS G13D 대장암의 생물학적 특성을 정밀 분석한 결과, 이 암에서 HER2 단백질이 과도하게 만들어지는 것이 약물 반응성이 떨어지는 주요 원인임을 밝혀냈다. 연구팀은 HER2 단백질이 ELF3 전사인자를 자극하고, 이 ELF3가 다시 KRAS 유전자의 발현을 촉진하는 'HER2–ELF3–KRAS 축'이 존재한다는 것을 세계 최초로 밝혀냈다. 또한 KRAS G13D 변이 대장암은 다른 암과 달리 HER2와 HER3라는 수용체가 짝을 이루는 작용에 더 의존적으로 증식한다는 점도 입증했다. -
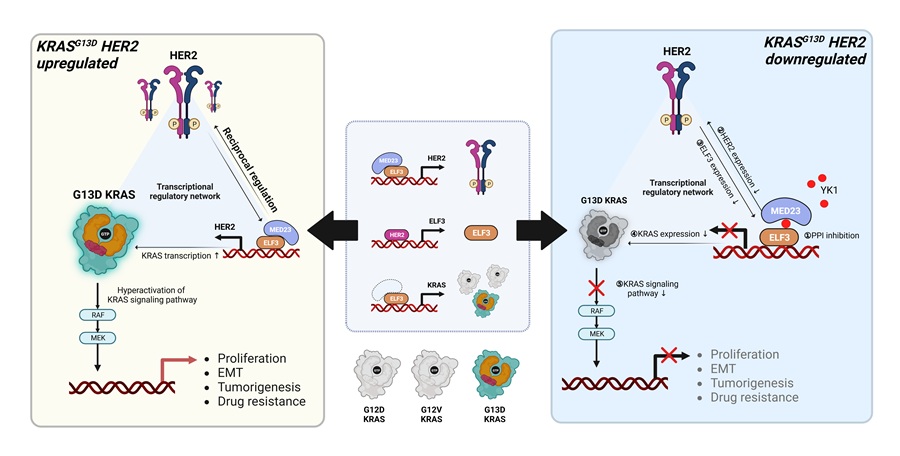
- ▲ 연구 이미지.ⓒ이화여대
연구팀은 나아가 이번 발견이 실질적인 치료 전략으로 확장될 가능성을 증명했다. 자체 개발한 단백질-단백질 상호작용 억제 물질 'YK1'을 이용해 HER2–ELF3–KRAS 축을 차단하는 실험을 진행한 결과, 기존 치료제(세툭시맙)에 반응하지 않던 KRAS G13D 대장암 세포가 다시 치료에 반응하는 것을 확인했다. 동물실험에서도 암의 성장을 효과적으로 억제하는 것을 입증했다.권영주 교수는 "이번 연구는 특정 유전자 변이를 가진 대장암에서만 선택적으로 활성화돼 있는 신호 전달 체계를 세계 최초로 입증하고, 표적 치료 전략을 제시했다는 점에서 중요하다"며 "기존 치료로는 효과를 보지 못했던 환자에게 맞춤형 치료 전략을 제공하고, 환자의 유전적 특성에 맞춘 정밀의료 시대를 앞당기는 데 기여할 것으로 기대된다"고 말했다.이번 연구 결과는 국제 저명 학술지 '분자암(Molecular Cancer)'에 지난달 9일 게재됐다. 이화여대 황수연 박사가 제1저자로 참여했다. 권영주 교수팀(첨단바이오·소재 인재양성교육연구단)을 비롯해 연세대 의과대학 김태일 교수, 차의과학대 나영화 교수, STEAM 과제 공동 연구진이 협업했다.이번 연구는 한국연구재단의 STEAM 과제와 중견연구자지원사업의 지원을 받아 수행했다. 실험에는 교육부와 한국기초과학지원연구원(국가연구시설장비센터)의 연구비 지원을 받아 설립된 이화 신약개발연구코어센터의 연구장비가 활용됐다. -

- ▲ 이화여자대학교 전경. 오측 하단은 이향숙 총장.ⓒ이화여대







